.U
X
о
ле сдвига фаз, чрезвычайно чувствительна к характеристикам е╦ компонент. Одним из примеров применения А. и. является измерение лэмбовского сдвига в атоме водорода,
Из ф-лы для двухэлектродного интерферометра следует, что эксперим. зависимость выхода 2Р-атомов от
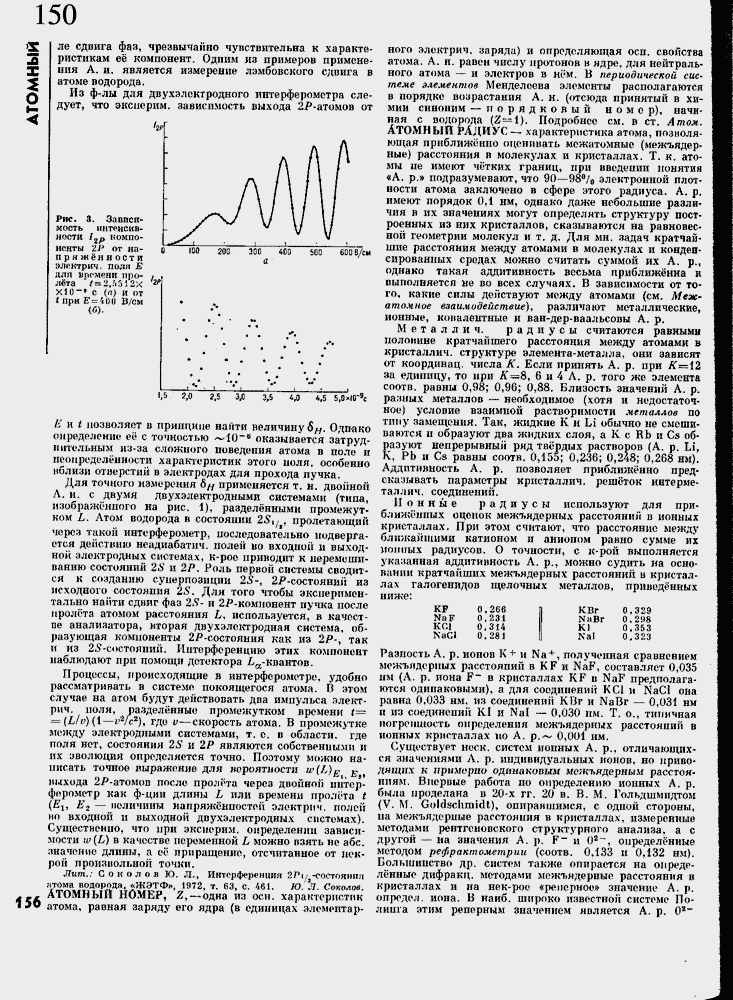
Ряс. 3, Зависимость ИНГРНСИВ-
ности 12р компоненты 'IP or на- в приж╦нности элоктрич. поля Е ддл времени про- /
∙∙ , съ - г Л *-. I1&
лета ? = 2,г*512Х * ХЮ~* с <л) и от (при E=4DO В/см (б)-
100 200 300 400 500 600 В/см
2,0 2,5 3,0 3,5
4,5
156
Е и t позволяет в принципе найти величину б//- Однако определение е╦ с точностью ~10~ti оказывается затруднительным из-за сложного поведения атома в поле и неопредел╦нности характеристик этого ноля, особенно вблизи отвь-рстий в электродах для прохода лучка,
Для точного измерения дн применяется т. н. двойной А. и. с двумя двухэлектродными системами (типа, изображ╦нного на рис, 1), раздел╦нными промежутком L. Атом водорода в состоянии 25^ , пролетающий через такой интерферометр, последовательно подвергается действию неадиабатич. полей во входной и выходной электродных системах, к-рос приводит к перемешиванию состояний 2S и 27*. Роль первой системы сводится к созданию суперпозиции 2S-, 2Р-состояний из исходного состояния 2S. Для того чтобы экспериментально найти сдвиг фаз 2S- и 2 /'∙компонент пучка после прол╦та атомом расстояния L, используется, в качестве анализатора, нторая двухэлсктродная система, образующая компоненты 2Р-состояния как из 2Р-, так и из 25-состояний. Интерференцию этих компонент наблюдают при помощи детектора £а-квантов.
Процессы, происходящие в интерферометре, удобно рассматривать в системо покоящегося атома. В этом случае на атом будут действовать дна импульса алект-рич. поля, раздел╦нные промежутком времени t= = (Llv}(\\ ≈ wa/c2}, где v ≈ скорость атома. В промежутке между электродными системами, т. с. в области, где поля нет, состояния 2S и 2Р являются собственными и их эволюция определяется точно. Поэтому можно написать точное выражение для вероятности w(L}F E
1ч 3 *
выхода 2Р-атомов после прол╦та через двойной интерферометр как ф-ции длины L или времени прол╦та t (Е1т Е2 ≈ величины напряж╦ныостод элсктрпм. полой но входной и выходной двухэлектродных системах). Существенно, что при экснерим. определении зависимости if (L) в качестве переменной L можно пзять не абс. значение длины, а ео приращение, отсчитанное от пек-рой произвольной точки.
Лит.: Соколов Ю. Л., Интерференция 2 Pi/2 -состояния нтома водород», «ЖЭТФ», 1972, т. 63, с. 461. Ю. Л. Соколов. АТОМНЫЙ НОМЕР, Z, ≈ одна из осн. характеристик атома, равная заряду его ядра (в единицах элементар-
ного электрич. заряда) и определяющая осп. свойства атома. А. н. равен числу протонов в ядре, для нейтрального атома ≈ и элсктров в ном. В периодической системе элементов Менделеева элементы располагаются в порядке возрастания А. н. (отсюда принятый в химии синоним ≈ порядковый номер), начиная с водорода (Z≈ 1). Подробнее см, в ст. Атом. АТОМНЫЙ РАДИУС ≈ характеристика атома, позволяющая приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Т. к. атомы не имеют ч╦тких границ, при введении понятия «А. р.» подразумевают, что 90≈98°/0 электронной плотности атома заключено в сфере этого радиуса. А. р. имеют порядок 0.1 нм, однако даже небольшие различия в их значениях могут определять структуру построенных из них кристаллов, сказываются на равновесной геометрии молекул и т. д. Для мн. задач кратчайшие расстояния между атомами в молекулах и конденсированных средах можно считать суммой их А. р., однако такая аддитивность весьма приближ╦нна и выполняется не во всех случаях. В зависимости от того, какие силы действуют между атомами (см. Межатомное взаимодействие], различают металлические, ионные, коналеитные и ван-дер-ваальсовы А. р.
Металлич. радиусы считаются равными ыолонине кратчайшего расстояния между атомами в кристаллич. структуре элемента-металла, они зависят от координац. числа К. Если принять А. р. при K=iZ за единицу, то при ^=8, 6 и 4 А. р, того же элемента соотв. равны 0,98; 0,96; 0,88. Близость значений А. р. разных металлов ≈ необходимое (хотя и недостаточное) условие взаимной растворимости металлов ш типу замещения. Так, жидкие К и Li обычно не смешиваются п образуют два жидких слоя, а К с Rb и Cs образуют непрерывный ряд тв╦рдых растворов (А. р. Li, К, Pb и Cs равны соотв. 0,155; 0,236; 0,248; 0,268 нм). Аддитивность А. р, позволяет приближ╦нно предсказывать параметры кристаллич. решеток интерме-таллич. соединений.
Ионные радиусы используют для приближ╦нных оценок меж т. ядерных расстоянии в ионных кристаллах. При этом считают, что расстояние между ближайшими катионом и анионом равно сумме их ионных радиусов. О точности, с к-рой выполняется указанная аддитивность А. р., можно судить на основании кратчайших межъядерных расстояний в кристаллах галогенидов щелочных металлов, привед╦нных ниже:
|
|
|
|
|
|
|
KF
|
0,266
|
|
|
|
NaF
|
0,231
|
|
|
|
КС1
|
0,314
|
|
|
|
NaCl
|
0,281
|
|
|
|
|
|
|
КБг
KI
Nal
0,329
0,298
0.353
0,323
Разность А. р. ионов К+ и Na + , полученная сравнением ыежъядерпых расстояний в KF и NaF, составляет 0,035 им (А. р. иона F~ в кристаллах KF в NaF предполагаются одинаковыми), а для соединений KCi n NaCl она равна 0,033 нм, из соединений КВт и NaBr ≈ 0,031 нм и из соединений KI и Nal ≈ 0,030 им. Т. о., типичная погрешность определения межъядерных расстояний в ионных кристаллах но А. р.~ 0,001 нм.
Существует неск. систем ионных А. р., отличающихся значениями А. р. индивидуальных ионов, но приводящих к примерно одинаковым мсжъядерным расстояниям. Впервые работа по определению ионных А. р. была проделана и 20-х гг. 20 в. В. М. Гольдшмидтоы (V. М. Goldsciimidt), опиравшимся, с одной стороны, па межъядерные расстояния в кристаллах, измеренные методами рентгеновского структурного анализа, а с другой ≈ на значения А. р. F~ u 02~, определ╦нные методом рефрактометрии (соотв. 0,133 и 0,132 нм). Большинство др. систем также опирается на определ╦нные дифракц. методами ме?къндерные расстояния в кристаллах и на нек-роо «репсрное» значение А. р. опредол. иона, В наиб, широко известной системе По-линга этим реперным значением является А. р, 02~
")
}


